采用 CytoFLEX 进行囊泡流式细胞术检测
摘要
细胞外囊泡(EV)是所有细胞都会释放的囊泡,通过携带不同的“货物”能够引起近端或远端细胞功能发生变化。对 EV 及其“货物”进行分析测定具有广泛的诊断适用性。如果能够操纵 EV 及其“货物””,将有望利用它们进行疾病的治疗。然而,现有分析方法存在严重的不确定性,导致该领域的发展裹足不前。纳米颗粒跟踪分析(NTA)等常见方法的粒径分辨率有限,无法检测 EV 的特异性,从而未能有效测定“货物”。用于测定 EV“货物”的蛋白质印迹法(Western Blot)或其他方法仅支持报告样品中“货物”的总量,而不能对单个 EV 上的“货物”进行分析。
以往仪器灵敏度和标准化程度低,非特异性的方法无法检出EV,随着仪器领域的创新发展,作为单个 EV“货物”分析的潜在理想平台 —— 流式细胞术,脱颖而出,如贝克曼库尔特的CytoFLEX,大大改善微弱信号的检测能力,为 EV 分析重燃希望。仪器的创新推动分析设计的发展,使标准化、特异性、可重现的 EV 表征成为可能。在本文中,我们将演示如何利用 Cellarcus 的 Vesicle Flow Cytometry(vFC™)试剂盒实现以下操作:
- 校准仪器,确定关键指标的性能
- 使用荧光膜探针 vFRed™ 灵敏地检测 EV,对 EV 浓度和粒径分布进行标准化测定
- 对 EV“货物”进行适当优化的单色和多色定量测量
单个EV分析的潜力和挑战
细胞外囊泡(EV)是所有细胞都会释放的囊泡,可将分子“货物”携带至近端或远端的细胞,从而影响这些细胞的功能。EV 的这种作用使其有望成为细胞间信号传导的介质以及诊断学和治疗学发展的潜在目标,前景广阔。而在这一领域中挖掘这种潜能则面临着一系列挑战1,主要问题在于 EV 及其“货物”分析方法往往存在非特异性、分辨率低且速度慢。
经查阅 MISEV (EV 研究最少信息)2 和EV-TRACK3 (EV 研究透明报告和集中知识),发现最常见的 EV 分析方法是将富集小颗粒的超速离心法(UC)和蛋白质印迹法相结合,用于检测 EV 选定“货物”是否存在。UC 沉淀颗粒通常需要进行纳米颗粒跟踪分析(NTA),以确定样品中纳米颗粒的浓度和粒径分布。由于 UC 会导致样品大量损耗、聚集物形成和非 EV 样品污染物共沉淀,使得数据解析难度增大4。NTA 基于光散射检测法的粒径分辨率有限,而且对 EV 检测没有特异性,使 UC 和其他浓缩方法的问题更加复杂。如同 Western Blot 这样的整体分析法仅支持报告样品中“货物”总量,未能提供单个 EV 上的“货物”信息。传统 EV 分析的这些局限性导致 EV 及其“货物”测定工作存在严重的不确定性,包括在含 EV制备液中检测到的“货物”是否与 EV 有关。此外,这些方法繁琐耗时且需消耗大量样品,限制了它们在临床应用中的作用。
这一领域的发展亟待一个能够以特异性为基础测定单个 EV 上“货物”的高分辨率和高通量的新工具。且在理想情况下,这些新工具无需大量的样品处理工作。
EV流式细胞术检测的标准化
流式细胞术脱颖而出,有望成为单 EV“货物”分析的理想平台,但部分限制因素阻碍其广泛应用5。首先,大多数用于细胞分析的流式细胞仪缺乏检测微弱 EV 信号所需的灵敏度,难以从噪声中解析信号。其次,大多数基于FC 的 EV 方法利用光散射检测颗粒,既缺乏特异性,也很难与噪声区分开此外,缺乏对适当校准品和对照品的理解和使用,使数据难以解析,并阻碍跨实验室间结果的比较。创新型分析仪提高了灵敏度,可用于检测 EV 和其他小颗粒。专用分析和报告提高了仪器灵敏度,使研究人员能够对 单个的EV 及其“货物”进行高灵敏度特异性定量测量。为实现 EV 检测和具有时空可比性的可重现表征,先进的分析仪和检测试剂不可或缺。
近期,随着仪器领域取得创新进展,仪器灵敏度大幅提升,非常适用于 EV 分析。以贝克曼库尔特 CytoFLEX 为例,这款产品的创新性设计使其具备卓越的光信号收集、光谱滤波以及检测器功能,可显著提高微弱信号的鉴别能力6.
此外,检测试剂的设计也取得了突破性进展,可配合高灵敏度的流式细胞仪进行更有效的 EV 测定。Cellarcus Vesicle Flow Cytometry (vFC™)试剂盒采用生成荧光的膜探针选择性检测膜囊泡并估计其大小,可获得于 NTA 或 RPS 检测法相同的数据,但优势在于其特异性更高、处理通量更大。该试剂盒还可以用于测定分子“货物”。vFC™ 试剂盒基于国际细胞外囊泡学会(ISEV)和国际流式细胞学会(ISAC)牵头的 EV 测定标准化工作指南设计而成。这些指南7 旨在通过针对基本细节报告提出达成共识的建议,从而满足 EV 研究和流式细胞术对严谨性和可重复性要求。它们指定了对照品和校准品框架(而 vFC™ 试剂盒集成了这些对照品和校准品),从而为跨实验室间方法和结果的比较起到了至关重要的促进作用,从而推进 EV 研究和临床发展。
vFC&trade:EV特异性定量测量
vFC™ 试剂盒 (图 1) 对传统上基于 FC 的 EV 的检测方法进行了优化,利用膜染色剂 vFRed™ 发射的荧光而非光散射选择性检测囊泡并估算其粒径。与基于光散射的检测方法相比,荧光激发式 EV 检测提高了灵敏度和特异性,并简化了样品制备、仪器设置和数据处理过程。vFC™试剂盒设计包含了 EV 严谨性、可重现性分析必不可少的校准品和对照品。与拥有卓越灵敏度的流式细胞仪(如 CytoFLEX6 ),配套使用时,vFC™ 可提供 EV 数量、粒径和分子“货物”的高灵敏度特异性测定结果,且该方法可重现、可扩展。

图 1. vFC™ 试剂盒工作流。(A)样品(未加工生物流体或浓缩组分)稀释(B)以 vFRed™ 以及经优化的荧光标记染料染色。(C)染色样品进一步稀释,并在高度灵敏的流式细胞仪上使用 vFRed™ 荧光触发检测进行分析。(D)数据校准和报告。
仪器性能与校准
仪器性能表征和校准是实现单胞外囊泡流式细胞术严谨性、可重现性的关键要素。仪器光学检测性能以光信号检测效率和背景噪声水平表征,背景噪声水平通常决定暗淡颗粒的分辨率。仪器射流性能通过样品体积流率和线性流率体现。仪器经校准后,这些测量结果支持以绝对单位表示,从而能够对不同仪器和不同时间的检测结果进行比较。
vFC™ 试剂盒包含仪器性能表征和校准所需的校准品和标准品。vCal™ nanoRainbow微球是一种亚微米级多峰多荧光团硬染色微球,可用于快速评估仪器性能。根据最亮微球的 CV 评估激光准直度,根据空白和暗淡微球之间的分离程度评估 vFRed™ 分辨率,可参照 MESF 微球或 vCal™ 校准抗体捕获微球评估和交叉校准免疫荧光通道强度,为日常检测提供稳健的校准颗粒。
多峰 vCal™ 校准抗体捕获微球 (图 2) 可用于 EV“货物”的多色免疫荧光定量测量。充分表征的合成和细胞源囊泡 (图 2C) 用作估计 EV 数量、粒径和分子“货物”的标准品。这些校准品和标准品用于定量测量,其结果具有时空可比性。

图 2. 仪器性能表征和校准。多峰多荧光团 nanoRainbow微球可用于评估(A)囊泡检测通道(vFRed™)和(B)免疫荧光(PE)通道的分辨率。可参照 MESF 微球(C)交叉校准 nanoRainbow 微球,从而提供仪器特异性校准微球组。
vFC™ 的EV检测和粒径测量
图 1. 典型的 vFC™ 试剂盒工作流示例。样品 A)稀释至可进行单 EV 分析的颗粒浓度,B)以荧光膜探针 (vFRed™)和其他探针(比如荧光抗体)染色,C)稀释后在 CytoFLEX 上分析,接着将数据 D)加载到软件包含的数据分析模板中,然后对测量数据进行校准和分析,以估算 EV 粒径和“货物”丰度。整个实验在 96 孔板上进行,可直接分析生物流体或浓缩培养上清液中的 EV,没有洗涤步骤或其他样品处理过程。
采用 CytExpert 软件预设的实验模板,包含有关滤光片配置、颗粒检测以及样品流速和采集时间等信息。为发挥vFC™ 的作用,仪器配置为以 vFRed™ 荧光触发检测,并记录 vFRed™ 脉冲宽度。对滤光片进行配置,使其无需中性密度滤光片即可检测 405nm 散射光(VSSC),并以60uL/min 速度(高流速)对每个孔取样 120 秒。使用标准化模板可确保在不同实验中仪器操作保持一致。
设门与数据分析
vFC™ 检测数据通过标准化分析布局进行分析,便于分析重现和数据共享。分析布局包括设门,设门目的是排除射流异常 (图 3A) 和背景细胞,同时选择具有特征荧光和光散射特性的细胞 (图 3B).

图 3. vFC™ 囊泡设门策略。标准化 vFCTM 设门包括 (A)创建时间门,排除样品增压所引起的射流伪迹,(B)vFRed™ 脉冲形状特征(高度和面积)设门,消除低强度背景,(C)圈选具有光散射特征和 vFRed™ 荧光的细胞。
囊泡粒径测定
在 vFC™ 中,通过 vFRed™ 荧光选择性检测囊泡;膜颗粒以 vFRed™ 染色后荧光强度与表面积成比例。vFC™ 利用这些特性根据荧光估算粒径。为了说明这一点,我们选取合成膜囊泡制剂 Lipo100™, 该制剂的粒径范围约为80-150nm,(图 4B)是以 NTA 或 RPS 法测定的囊泡群,然后使用 vFRed™ 染色并测定荧光 (图 4A)。绘制Lipo100™ 表面积(假定为球形,通过正交法测量直径,用直径测量值计算表面积)与荧光强度关系图(图 4C),发现两者存在线性关系 (图 4D) 使用该拟合直线(单位:荧光单位/nm2)的斜率基于荧光强度估算 Lipo100™ 粒径(图 4E、图 4F)。因此,如果采用适当的囊泡粒径标准,则 vFC™ 提供的 EV 粒径和浓度估算值等同于 NTA或 RPS 检测法,不过 vFC™ 试剂盒具有囊泡选择性,而这两种方法没有这种功能。

图 4. vFC™ 粒径校准。vFC™ 粒径校准采用已经 NTA 或RPS 等独立方法估算直径(A)和表面积(B)的合成脂质囊泡(Lipo100)。vFRed 荧光分布(C)与表面积分布直接相关,可计算出 vFRed 强度 /表面积(D),并利用该值将 vFRed 荧光表示为等效表面积(E)或直径(F)。
特异性对照品
vFC™ 检测方案包含确定检测灵敏度和 EV 特异性所需的对照品 (图 5) 。整个孔板装有仅含缓冲液对照品和仅含试剂对照品,创建可定义灵敏度(图 5A)的背景颗粒和信号水平。一次典型的 vFC™ 试验分析 100uL 染色稀释样品,仅含缓冲液对照品产生的背景细胞 <1000 个,仅含 vFRed™ 对照品产生的背景细胞 <2000 个,考虑到样品处理过程的稀释步骤,保守检测限(LOD)为(背景平均值+ 2 SD)/uL、<5000 个细胞或 >5e4/uL。

图 5. vFC™ 检测特异性对照品。(A)仅含试剂对照品可用于估算含囊泡样品中背景细胞的数量。(B)洗涤剂敏感性试验证实被检测细胞具有囊泡性质。(C)样品系列稀释液确定检测动态范围和灵敏度,并检查并发情况(又称“群”检测)。
洗涤剂对照品证明被检测细胞具有囊泡性质 (图 5B)。EV 和其他囊泡对洗涤剂较为敏感,添加约 0.1% 洗涤剂后囊泡会被破坏和溶解。加入洗涤剂后,所测得的仅含试剂对照品背景信号略有增强,但在被检测细胞具有囊泡性质的样品中,>90% 细胞被消除。大多数非囊泡颗粒,包括蛋白质聚集体和脂蛋白,可耐受洗涤剂处理,因此,如果检测到耐洗涤剂细胞,表明存在此类非囊泡污染物。
系列稀释对照品有助于确定检测是否测量单颗粒 (图 5C) 如果样品中 EV 数量在检测线性范围内,则样品中细胞数量随稀释成比例减少,但是群分布(和/或中位数或平均值等汇总统计数据)没有显著变化。例如, 图 5D 显示细胞数量随稀释而减少的线性关系。然而,直径分布保持不变。如果群亮度(以及中位数和平均值)也明显下降,则表明检测到多颗粒。
系列稀释对照品还可以创建检测线性和动态范围,该范围一般从仅含试剂对照品的背景细胞计数(约 2000/100uL)拓展至约 500,000 细胞/100uL,超过这一点经常可以观察到并发情况。一般来说,试剂和标准品配置为可检测约 50,000 细胞/100uL,检测工作范围上限为该目标值的 10 倍,下限为其十分之一。
vFC™ EV “货物”测定
其他试剂盒的关键局限性之一是无法在单个 EV 水平上测定 EV“货物”。为充分了解 EV 异质性并表征 EV亚群,需要进行单个 EV“货物”的测定。vFC™ 与高灵敏度 CytoFLEX 配套使用,除了特异性定量测定 EV 数量和大小,还可进行 EV“货物”免洗定量测定。EV“货物”可以通过几种方式进行标记,包括荧光蛋白融合表达、化学或酶标记或以荧光标记抗体染色,其中免疫荧光在特定蛋白质(尤其是膜表面蛋白质)测定方面最为适用。使用 vFC™ 对 EV 进行免疫荧光检测,其原理与细胞免疫荧光检测相同,包括染色优化、特异性验证、组合设计和荧光校准原理。
vFC™ 免疫荧光
EV 表面“货物”测定水平取决于经校准的仪器、经验证的抗体以及经优化的染色试剂。使用适当的校准试剂,并将已知阳性和阴性样品染色后作为对照材料以证明相应的特异性和敏感性,即可充分完成“vFC™”免疫荧光优化和验证。例如,图 6 显示四次跨膜蛋白 vTag™ 抗体的工作流,该抗体是为符合 MISEV 指导要求而在 vFC™ 计数和粒径分析试剂盒中使用的传统阳性 EV 标记。这种抗体组合包含多个单克隆抗体,它们对突出的四次跨膜蛋白 CD9、CD63 和 CD81 具有特异性。通过抗体滴定和适当的对照,对每种抗体及混合物的结合特性进行优化。抗体滴定可确定亮度最大且背景信号尽可能弱的饱和浓度。以充分表征的人血小板(PLT)源 EV 作为阳性对照、不含蛋白质抗原 Lipo100™ 囊泡标准品作为阴性对照,证明染色特异性。试验应考虑添加同型对照,用于测量非特异性 Fc 相互作用的信号。如果同型对照信号强,必须使用 Fc 阻断剂预处理。Tag™ 抗人 TS 混合物已经过数十种样品的EV 验证。

图 6. vFC™ 免疫荧光。(A)阳性对照囊泡(PLT EV)抗体滴定可优化抗体染色条件(B)分辨未染色对照(阴影直方图)。(C)缺少抗原的囊泡(Lipo100)可用作阴性对照。(D)不相关的同型对照可揭示 Fc 受体介导的抗体结合。
注:在单色染色实验中,PE 因其亮度和广泛的可用性,已成为理想的偶联物选择。此外,利用对照颗粒将 PE 荧光校准为 MESF 单位后,数据可使用绝对单位表示,这意味着,每个单独标记的 PE 偶联物相当于每个囊泡的抗体分子。也可以根据适当的组合设计使用其他颜色。
多色免疫荧光
与细胞的流式细胞术一样,将单色免疫荧光测量扩展为多色组合需要考虑适当组合设计的原则。EV 表面“货物”的最佳检测方法是使用 PE 偶联物,因为它们亮度高、广泛且易于采用如上文所述的商业试剂进行校准。但是,如果测量多个“货物”,则需要设计和优化适当的多色染色组合。应考虑的关键点包括:可用偶联物的亮度、感兴趣目标丰度、预期的标记共表达。
为了说明该问题,我们将考虑使用多色组合对源于血液中最丰富的两种细胞 PLT 和红细胞(RBC)的 EV 进行染色。RBC 含有丰富的 CD235(血型糖蛋白),这种蛋白质仅在 RBC 及其未成熟阶段的网织红细胞上表达,不在血小板上表达。另一方面,CD41(整合素 α2)在血小板及血小板生成型巨核细胞上高度表达,但在 RBC 中不存在。 图 7 显示多色 vFC™ 试剂盒通过血小板和红细胞囊泡各自的“货物”识别这些囊泡。使用与促凝血剂阴离子磷脂磷脂酰丝氨酸(PS)结合的膜联蛋白 V 对表达表面PS 的 EV 进行染色。与细胞分析中的组合设计一样,vFC™ 组合设计考虑到抗原丰度、荧光团亮度、光谱分辨率以及可用性。PE 亮度高且广泛可用,在这里用于标记CD235,CD41和膜联蛋白V则分别用BV421和PECy5标记,后两者亮度也非常高且光谱可区别。抗体捕获微球染色后,可用于评估不同偶联物所提供的分辨率(使用 PECy5 抗体,因为膜联蛋白 V 并非抗体),强度可报告为每个囊泡结合的抗体(或膜联蛋白 V)数量。以洗涤 PLT 和洗涤 RBC 制备的 EV 制剂完成染色,可证明 CD235 和 CD41染色的特异性,并揭示 PLT EV 和RBC EV 均在其表面表达 PS,不过 RBC EV 表面表达量仅约为 PLT EV 表面表达量的十分之一。
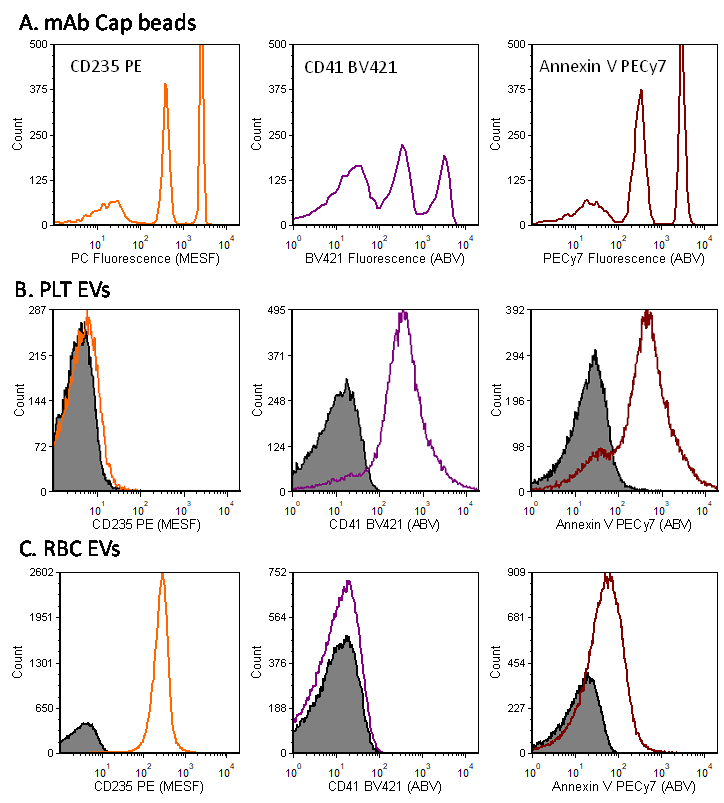
图 7. vFC™多色免疫荧光。(A)多标记组合中所用荧光染料偶联物的亮度可通过 vCal™ 抗体捕获纳米微球测定和校准。使用该微球后,免疫荧光可表示为每个囊泡结合的抗体数量(ABV),从而阐明和校准细胞特异性和通用 EV 标记的特异性和丰度,比如(B)CD41 和膜联蛋白 V 在 PLT 源 EV 上的表达以及(C)CD235 和膜联蛋白 V 在 RBC 源 EV 上的表达。
总结与展望
EV 作为细胞间信号传递载体、疾病诊断生物标志物和治疗剂而备受关注,但所有这些领域的研究皆因无法对单个 EV 进行灵敏、可重现的定量分析而进展缓慢1。流式细胞术有望成为 EV 测量的首选方法,但是传统的流式分析仪和试剂缺乏灵敏性和特异性5。vFC™ 试剂盒利用新一代高灵敏度流式细胞仪,如贝克曼库尔特的 CytoFLEX6, 可灵敏地分析特定 EV 的数量、大小以及“货物”。vFC™ 与 CytoFLEX配套使用,将优化的试剂和样品制备分析方案与灵敏测量 EV 荧光和散射光的技术相结合,可检测约 75nm 的 EV,可检测的 EV 表面抗体数量约为每个囊泡 25 个分子。通过使用经优化设计和验证的多色染色组合,我们便可揭示独特的 EV 表面特征,从而获知起始细胞、可能的靶细胞以及他们的潜在功能等信息。这些数据对于开发信息丰富的生物标志物、制定治疗策略以及更好地理解这些不同实体形成和发挥作用的机制将不无裨益。
参考文献
- Margolis, L.; Sadovsky, Y., The biology of extracellular vesicles: The known unknowns. PLOS Biology 2019, 17 (7), e3000363.
- Théry, C.; Witwer, K. W.; Aikawa, E.; Alcaraz, M. J.; Anderson, J. D.; Andriantsitohaina, R.; Antoniou, A.; Arab, T.; Archer, F.; Atkin-Smith, G. K.; Ayre, D. C.; Bach, J.-M.; Bachurski, D.; Baharvand, H.; Balaj, L.; Baldacchino, S.; Bauer, N. N.; Baxter, A. A.; Bebawy, M.; Beckham, C.; Bedina Zavec, A.; Benmoussa, A.; Berardi, A. C.; Bergese, P.; Bielska, E.; Blenkiron, C.; Bobis-Wozowicz, S.; Boilard, E.; Boireau, W.; Bongiovanni, A.; Borràs, F. E.; Bosch, S.; Boulanger, C. M.; Breakefield, X.; Breglio, A. M.; Brennan, M. Á.; Brigstock, D. R.; Brisson, A.; Broekman, M. L. D.; Bromberg, J. F.; Bryl-Górecka, P.; Buch, S.; Buck, A. H.; Burger, D.; Busatto, S.; Buschmann, D.; Bussolati, B.; Buzás, E. I.; Byrd, J. B.; Camussi, G.; Carter, D. R. F.; Caruso, S.; Chamley, L. W.; Chang, Y.-T.; Chaudhuri, A. D.; Chen, C.; Chen, S.; Cheng, L.; Chin, A. R.; Clayton, A.; Clerici, S. P.; Cocks, A.; Cocucci, E.; Coffey, R. J.; Cordeiro-da-Silva, A.; Couch, Y.; Coumans, F. A. W.; Coyle, B.; Crescitelli, R.; Criado, M. F.; D’Souza-Schorey, C.; Das, S.; de Candia, P.; De Santana, E. F.; De Wever, O.; del Portillo, H. A.; Demaret, T.; Deville, S.; Devitt, A.; Dhondt, B.; Di Vizio, D.; Dieterich, L. C.; Dolo, V.; Dominguez Rubio, A. P.; Dominici, M.; Dourado, M. R.; Driedonks, T. A. P.; Duarte, F. V.; Duncan, H. M.; Eichenberger, R. M.; Ekström, K.; El Andaloussi, S.; Elie-Caille, C.; Erdbrügger, U.; Falcón-Pérez, J. M.; Fatima, F.; Fish, J. E.; Flores-Bellver, M.; Försönits, A.; Frelet-Barrand, A.; Fricke, F.; Fuhrmann, G.; Gabrielsson, S.; Gámez-Valero, A.; Gardiner, C.; Gärtner, K.; Gaudin, R.; Gho, Y. S.; Giebel, B.; Gilbert, C.; Gimona, M.; Giusti, I.; Goberdhan, D. C. I.; Görgens, A.; Gorski, S. M.; Greening, D. W.; Gross, J. C.; Gualerzi, A.; Gupta, G. N.; Gustafson, D.; Handberg, A.; Haraszti, R. A.; Harrison, P.; Hegyesi, H.; Hendrix, A.; Hill, A. F.; Hochberg, F. H.; Hoffmann, K. F.; Holder, B.; Holthofer, H.; Hosseinkhani, B.; Hu, G.; Huang, Y.; Huber, V.; Hunt, S.; Ibrahim, A. G.-E.; Ikezu, T.; Inal, J. M.; Isin, M.; Ivanova, A.; Jackson, H. K.; Jacobsen, S.; Jay, S. M.; Jayachandran, M.; Jenster, G.; Jiang, L.; Johnson, S. M.; Jones, J. C.; Jong, A.; Jovanovic-Talisman, T.; Jung, S.; Kalluri, R.; Kano, S.-i.; Kaur, S.; Kawamura, Y.; Keller, E. T.; Khamari, D.; Khomyakova, E.; Khvorova, A.; Kierulf, P.; Kim, K. P.; Kislinger, T.; Klingeborn, M.; Klinke, D. J.; Kornek, M.; Kosanović, M. M.; Kovács, Á. F.; Krämer-Albers, E.-M.; Krasemann, S.; Krause, M.; Kurochkin, I. V.; Kusuma, G. D.; Kuypers, S.; Laitinen, S.; Langevin, S. M.; Languino, L. R.; Lannigan, J.; Lässer, C.; Laurent, L. C.; Lavieu, G.; Lázaro-Ibáñez, E.; Le Lay, S.; Lee, M.-S.; Lee, Y. X. F.; Lemos, D. S.; Lenassi, M.; Leszczynska, A.; Li, I. T. S.; Liao, K.; Libregts, S. F.; Ligeti, E.; Lim, R.; Lim, S. K.; Linē, A.; Linnemannstöns, K.; Llorente, A.; Lombard, C. A.; Lorenowicz, M. J.; Lörincz, Á. M.; Lötvall, J.; Lovett, J.; Lowry, M. C.; Loyer, X.; Lu, Q.; Lukomska, B.; Lunavat, T. R.; Maas, S. L. N.; Malhi, H.; Marcilla, A.; Mariani, J.; Mariscal, J.; Martens-Uzunova, E. S.; Martin-Jaular, L.; Martinez, M. C.; Martins, V. R.; Mathieu, M.; Mathivanan, S.; Maugeri, M.; McGinnis, L. K.; McVey, M. J.; Meckes, D. G.; Meehan, K. L.; Mertens, I.; Minciacchi, V. R.; Möller, A.; Møller Jørgensen, M.; Morales-Kastresana, A.; Morhayim, J.; Mullier, F.; Muraca, M.; Musante, L.; Mussack, V.; Muth, D. C.; Myburgh, K. H.; Najrana, T.; Nawaz, M.; Nazarenko, I.; Nejsum, P.; Neri, C.; Neri, T.; Nieuwland, R.; Nimrichter, L.; Nolan, J. P.; Nolte-’t Hoen, E. N. M.; Hooten, N. N.; O’Driscoll, L.; O’Grady, T.; O’Loghlen, A.; Ochiya, T.; Olivier, M.; Ortiz, A.; Ortiz, L. A.; Osteikoetxea, X.; Ostegaard, O.; Ostrowski, M.; Park, J.; Pegtel, D. M.; Peinado, H.; Perut, F.; Pfaffl, M. W.; Phinney, D. G.; Pieters, B. C. H.; Pink, R. C.; Pisetsky, D. S.; Pogge von Strandmann, E.; Polakovicova, I.; Poon, I. K. H.; Powell, B. H.; Prada, I.; Pulliam, L.; Quesenberry, P.; Radeghieri, A.; Raffai, R. L.; Raimondo, S.; Rak, J.; Ramirez, M. I.; Raposo, G.; Rayyan, M. S.; Regev-Rudzki, N.; Ricklefs, F. L.; Robbins, P. D.; Roberts, D. D.; Rodrigues, S. C.; Rohde, E.; Rome, S.; Rouschop, K. M. A.; Rughetti, A.; Russell, A. E.; Saá, P.; Sahoo, S.; Salas-Huenuleo, E.; Sánchez, C.; Saugstad, J. A.; Saul, M. J.; Schiffelers, R. M.; Schneider, R.; Schøyen, T. H.; Scott, A.; Shahaj, E.; Sharma, S.; Shatnyeva, O.; Shekari, F.; Shelke, G. V.; Shetty, A. K.; Shiba, K.; Siljander, P. R. M.; Silva, A. M.; Skowronek, A.; Snyder, O. L.; Soares, R. P.; Sódar, B. W.; Soekmadji, C.; Sotillo, J.; Stahl, P. D.; Stoorvogel, W.; Stott, S. L.; Strasser, E. F.; Swift, S.; Tahara, H.; Tewari, M.; Timms, K.; Tiwari, S.; Tixeira, R.; Tkach, M.; Toh, W. S.; Tomasini, R.; Torrecilhas, A. C.; Tosar, J. P.; Toxavidis, V.; Urbanelli, L.; Vader, P.; van Balkom, B. W. M.; van der Grein, S. G.; Van Deun, J.; van Herwijnen, M. J. C.; Van Keuren-Jensen, K.; van Niel, G.; van Royen, M. E.; van Wijnen, A. J.; Vasconcelos, M. H.; Vechetti, I. J.; Veit, T. D.; Vella, L. J.; Velot, É.; Verweij, F. J.; Vestad, B.; Viñas, J. L.; Visnovitz, T.; Vukman, K. V.; Wahlgren, J.; Watson, D. C.; Wauben, M. H. M.; Weaver, A.; Webber, J. P.; Weber, V.; Wehman, A. M.; Weiss, D. J.; Welsh, J. A.; Wendt, S.; Wheelock, A. M.; Wiener, Z.; Witte, L.; Wolfram, J.; Xagorari, A.; Xander, P.; Xu, J.; Yan, X.; Yáñez-Mó, M.; Yin, H.; Yuana, Y.; Zappulli, V.; Zarubova, J.; Žėkas, V.; Zhang, J.-y.; Zhao, Z.; Zheng, L.; Zheutlin, A. R.; Zickler, A. M.; Zimmermann, P.; Zivkovic, A. M.; Zocco, D.; Zuba-Surma, E. K., Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles 2019, 8 (1), 1535750.
- Van Deun, J.; Mestdagh, P.; Agostinis, P.; Akay, Ö.; Anand, S.; Anckaert, J.; Martinez, Z. A.; Baetens, T.; Beghein, E.; Bertier, L., EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods 2017, 14 (3), 228-232.
- Linares, R.; Tan, S.; Gounou, C.; Arraud, N.; Brisson, A. R., High-speed centrifugation induces aggregation of extracellular vesicles. Journal of Extracellular Vesicles 2015, 4.
- Nolan, J. P., Flow Cytometry of Extracellular Vesicles: Potential, Pitfalls, and Prospects. Current Protocols in Cytometry 2015, 73 (1), 13.14.1-13.14.16.
- Brittain, G. C.; Chen, Y. Q.; Martinez, E.; Tang, V. A.; Renner, T. M.; Langlois, M.-A.; Gulnik, S., A Novel Semiconductor-Based Flow Cytometer with Enhanced Light-Scatter Sensitivity for the Analysis of Biological Nanoparticles. Scientific Reports 2019, 9 (1), 16039.
- Welsh, J. A.; Van Der Pol, E.; Arkesteijn, G. J. A.; Bremer, M.; Brisson, A.; Coumans, F.; Dignat-George, F.; Duggan, E.; Ghiran, I.; Giebel, B.; Gorgens, A.; Hendrix, A.; Lacroix, R.; Lannigan, J.; Libregts, S.; Lozano-Andres, E.; Morales-Kastresana, A.; Robert, S.; De Rond, L.; Tertel, T.; Tigges, J.; De Wever, O.; Yan, X.; Nieuwland, R.; Wauben, M. H. M.; Nolan, J. P.; Jones, J. C., MIFlowCyt-EV: a framework for standardized reporting of extracellular vesicle flow cytometry experiments. J Extracell Vesicles 2020, 9 (1), 1713526.

