用以遵守《美国联邦法规》第 21 章第 11 款的 CytExpert 工具
所有储存用于制订质量决策的数据或需向美国食品药品监督管理局报告的数据的计算机系统均需遵守《美国联邦法规》第 21 章第 11 款的规定。法律的目的是定义在何种标准下电子记录和电子签名被视为值得信赖、可靠,并与纸质记录具有相同效力。
《美国联邦法规》第 21 章第 11 款是指《美国联邦法规》中阐明美国食品药品监督管理局 (FDA) 关于使用电子记录和电子签名规定的部分。该法规的适用众多监管行业,包括药品、生物制剂、医疗设备和食品产品(人和动物)。在美国开展所述业务的公司、制药公司的原材料和成分供应商以及委托分析的合约实验室必须确保其电子记录且电子签名真实、可靠。
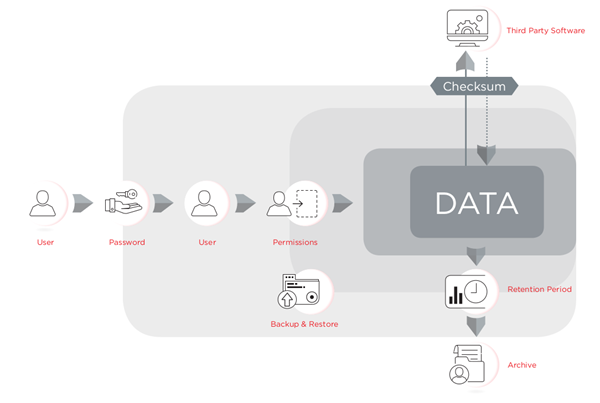
该法规要求机构实行三级控制:行政管理控制,如电子记录政策;程序控制,如使用系统的标准操作程序;以及技术控制,将功能内置于软件,确保电子记录和电子签名的可靠性和完整性。软件可进行设计以符合《美国联邦法规》第 21 章第 11 款的技术控制规定,但是实验室人员需负责提供政策和程序来确保正确使用软件并确保其使用流程符合法规的规定。已对用于 CytoFLEX 流式细胞仪平台的 CytExpert v2.3 电子记录管理系统进行设计使其更加符合《美国联邦法规》第 21 章第 11 款的规定。CytExpert v2.3 是控制仪器操作的密码保护软件,使用校验和和核查追踪保障数据完整性控制,并使用签名、签名层级和存档来进行文档控制。