自动化生物制药质量控制以降低成本并提高数据完整性
摘要
一份报告显示:一家制药企业平均每年在质量控制上的花费约为 4000 万美元1。与此同时,另一份报告指出:美国食品药品监督管理局(FDA)在 2016 年发出的 483 封警告信中,约有 79% 的信中引用了 «联邦法规21章»第11款(以下简称:21 CFR Part 11)有关数据完整性方面的问题2。尽管对团队人员进行再培训是企业对这些警告信的常见回应,然而却治标不治本:仅仅是因为技术人员未能正确遵循 SOP(标准操作程序),还是手动 SOP 不够健全,不足以防止人为错误的再次发生?任何自动化的质量控制 SOP既能减少人为错误对数据完整性的影响,还能减少技术人员手动执行 SOP 所需的大量时间,从而节省成本。本文探究了四种常见的质量控制过程,以及自动化如何通过减少人为错误来帮助提高数据完整性,同时节省时间、降低运营成本。本文所讨论的四种质量控制过程(即水质检测、洁净室常规环境监测、生物细胞计数与活率分析,以及注射制剂不溶性微粒检测)形成了当前生物制药行业发展所面临的共同主题。
请滚动至本页底部,点击观看由全球产品经理 Tony Harrison 主持的在线网络讲堂。
简介
尽管有来自 FDA 2004 PAT倡议3的鼓励,制药行业中许多常规的质量控制(以下简称 QC)检测过程仍然非常耗时耗力。由 Industrial BioDevelopment Laboratory 开展的一项研究表明:16 名有经验的 QC 技术人员执行相同的手动 SOP,检测结果的差异性大于 20%4。显然,手动 SOP 仍待改进,而技术人员仍需再培训。但检测结果的这一差异性表明:手动程序本身不够健全,不足以实现所需的质量控制水平。虽然类似仪器的技术参数看似相同,但 QC 团队在努力提高质量控制的同时,更应关注仪器的自动化水平,从而使 QC 检测结果可重复且更加可靠。例如,样品制备是 QC 检测中的一个常见误差来源,而通过样品制备自动化仪器可提高 QC 检测的重现性和可靠性4。
此外,根据 FDA PAT 倡议,企业可考虑从仅依赖实验室的 QC 检测转而使用在线 QC 分析仪。例如,许多公司已在其纯化水(PW)和注射用水(WFI)回路上验证了在线水质检测分析仪的有效性,却仍依赖耗时的实验室水质检测来进行产品放行检测。若在线仪器已经过验证且满足药典标准的要求,那么转而使用在线仪器,至少能够帮助企业减少实验室检测的频次。在线仪器自动化可避免人为错误,使检测更加可靠,从而提高数据完整性,同时降低 QC 成本。
纯化水(PW)和注射用水(WFI)的 QC 检测
TOC 和电导率是美国药典3中为 WFI 和 PW(纯净水)定义的四项关键质量属性中的其中两项。贝克曼库尔特公司的 ANATEL PAT700 等在线分析仪已经过验证,完全符合药典对这两项关键质量属性的检测要求。
FDA 过程分析技术(PAT)倡议4鼓励制药行业投资在线过程控制仪器,以确保过程质量控制,而非严重依赖最终产品质量检测。此外还鼓励企业批量生产的质量检测一次过关,因为药品的最终产品测试是一种破坏性测试,因此无法进行 100% 批量测试—— 取样和检测过程中的一个失误就可能使整批产品全部报废。为此,许多制药企业将他们的在线 TOC 分析仪接入工厂控制系统,以便在检测到任何潜在 TOC 和电导率偏移时停止生产,并防止可能受到污染的水混入宝贵的活性药物成分中。
随着《欧洲药典》(EP)中关于 WFI 章节的修订,现已允许使用二级反渗透系统(RO)和超滤12生产 WFI,与水蒸馏器提供的安全屏障相比,制药用水系统的 TOC 和电导率监测因可感知 RO 系统中潜在的破坏性污染风险而愈发重要。
FDA 规定的 PW 和 WFI 的四个水质属性为:
- 无机
- 有机
- 内毒素
- 微生物
FDA 在其指南中强调 21 CFR Part 11 的规定仅适用于保存电子记录的历史数据10。内置本地历史数据记录器的在线仪器面临的风险是,它们可能会违反 21 CFR Part 11 规定的全部要求。采用 PAT700 等分析仪可通过允许禁用本地数据历史记录来避免这一问题,从而确保作为电子记录数据存档的历史记录不会违反 21 CFR Part 11 的要求。
来自在线 TOC 分析仪的数据历来被储存于经验证的数据采集和监视控制系统(SCADA)或分布式控制系统(DCS)中,这为过程控制的改进带来挑战,并增加了大量的变更控制操作。更现代的方法是将质量关键数据记录保存在一个单独的安全档案中,将 SCADA 和 DCS 系统专门用于过程控制,使操作更为灵活。为此可将 PAT700 配置为通过以太网使用安全的 FTP 自动发送 PDF 电子记录,从而满足 ALCOA 原则对电子记录的易读性、同步性、原始性和可归属性要求。
实验室水质检测仪器需要使用试剂、手动配置每个样品、频繁(通常为每日)进行校准。而在线 PAT700 无需试剂,可实现检测自动化,且只需每 12 个月校准一次。校准和系统适用性检测 SOP 均为自动化,无需手动输入数据,可自动生成合格/不合格报告而无需人工进行计算。

图 1. ANATEL PAT700 通过以太网直接将 PDF 数据导出至数据库并存档。PAT700 校准标准通过 RFID 射频识别技术自动导出认证值、批次号和有效期等信息。
洁净室常规环境监测
FDA规定了洁净室中生物药/化药生产的空气质量条件。然而,真正的危险却来自于人体上的微生物。人体每小时脱落约 30000 个皮肤细胞5,这些细胞都是微生物的潜在载体。遗憾的是,目前尚未开发出实时监测空气微生物的技术,所以空气颗粒计数器成为不可或缺的替代品。

图 2. 人类和微生物污染
作者与世界各地工厂的环境监测经理之间的讨论表明,一个日益增长的趋势是,进行环境监测的负担正从质控微生物团队转移到生产人员,原因有两个:a)微生物人员相对而言 进行此类日常任务的成本很高; b)减少了洁净室内的人数,从而减少了产品污染的可能性。 但是,生产团队对日常环境监测的了解程度不高,这本身就构成了挑战。
在较大的生物制药工厂中,可能有10名或更多技术人员组成的团队,每个月要收集数千个常规环境监测样本。 在每个位置,他们必须在开始采样之前在计数器中手动输入位置名称。 必须按照书面的SOP手动配置计数器。 每天结束时,必须对每个样品位置的纸张打印输出进行复印,因为颗粒计数器中的打印机是热敏的,打印输出随时间而褪色。 然后,必须手动将每个位置的结果逐一转换为电子格式。
手动洁净室常规环境监测 SOP
| 接触点1 |
接触点2 |
接触点3 |
接触点4 |
接触点5 |
|
• 确保SOP 正确无误 |
手动输入每个采样点的名称 | 手动配置计数仪: • 采样时间 • 样本数量 • 结果平均值 •正确的换算为m3 |
打印文件并复印 | 手动转录测量结果 |
为了提高数据完整性,一些制造商专门针对制药 QC 使用优化了他们的粒子计数仪器,在仪器设计中内置了预配置电子 SOP 的功能,包括:
- 自动设置和配置
- 按 GMP 标准,自动生成合格/不合格报告
- 测量后直接生成符合 21CFR part 11 标准的电子记录
用户只需选择仪器中预先配置的电子 SOP,按下仪器上的“开始”按钮,仪器便会根据 SOP 自行正确配置,执行正确测试,并生成测试结果的电子记录 —— 全程自动化。从而不仅提高了数据的完整性,还可以帮助降低成本,技术人员无需花时间手动将纸质文件整理和转录为电子记录。此外,自动化 SOP 使操作人员无需专业技术即可操作空气颗粒计数器,同时也有助于企业将常规环境监测任务从专业的质控微生物团队转移至洁净室生产人员手中,从而帮助企业进一步降低成本。
电子 SOP 革新常规环境监测工作流
手动 SOP
| 接触点 1 |
接触点 1 |
接触点 1 |
接触点 1 |
接触点 1 |
| 手动 SOP | 手动输入采样点名称 | 手动配置计数器: | 手动传输数据 | 审核和批准 |
电子 SOP
| 接触点 1 |
接触点 1 |
|||
| 从计数器屏幕中选择预先配置的 SOP |
|
审核和批准 Excel、PDF 或 XML 中的测量结果 | ||
细胞活率检测
同质细胞群形式的细胞治疗产品通常根据细胞染色排除法(例如台盼蓝)计算浓度和活率。这种计算通常是采用显微镜和血球计数板人工完成,但此方法既耗时又容易出错。血球计数板方法中使用的样品体积最初用于计算血细胞数量,通常只有 100 纳升。使用该方法时,技术人员在样品稀释、混合、移液和可视计算中的小错误都可能导致结果中的大误差,因为需将最终计数结果相乘,以报告细胞浓度(活细胞数/mL)。 一项研究显示:16 名经验丰富、知识渊博的技术人员使用血球计数板法得出的细胞浓度结果的差异性高达 +/-20%4。
美国药典第 1046 章9指出:全自动细胞计数和活率分析仪可提供更高的测量精度和可重现性结果。如果样品制备阶段能够实现自动化,这些改进也能实现最优化,从而减少技术人员人为错误的可能性。此外,如果全自动细胞计数器可以使用与用户设计的细胞计数手动 SOP 相匹配的、预编程的细胞计数电子 SOP,那么检测结果将更准确、更具可重现性。除了提高精度和重现性,全自动化细胞计数器还允许技术人员在计数器自动化样品制备和计数时执行其他任务,从而降低 QC 检测的成本。支持 96 孔板上样的计数器可节省技术人员的大量时间,从而降低 QC 成本。同时,自动化细胞计数 SOP 使 QC 检测更可靠,并可同步创建电子记录,提高数据完整性和合规性,从而满足 21CFR part 11 指南中FDA 有关 ALCOA 原则对电子记录的易读性、同步性、原始性和可归属性要求。
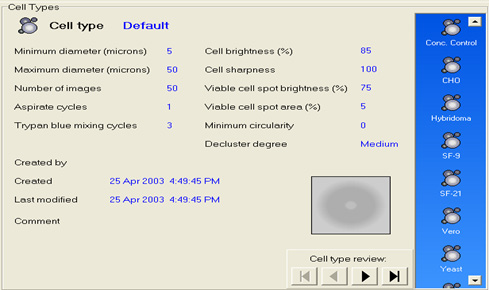
图 3. 全自动 Vi-CELL XR 细胞计数与活率分析仪 SOP 库示例
注射制剂终产品不溶性微粒检测
尽管业界对注射制剂不溶性微粒检测的要求基本一致,但不同国家和不同产品之间仍然存在差异。待分析样品体积以及报告结果的格式也因产品而异。例如,小体积生物注射制剂(如疫苗7)的采样要求与大体积注射制剂(如静脉滴注输液袋8)的要求不同。结果必须以正确的格式进行计算和表达,例如每容器的计数,或每毫升的计数,均取决于待测样品。

图 4. 不溶性微粒检测报告取决于产品
虽然通用型液体颗粒计数仪也可用于测试注射制剂中的不溶性微粒,但由于测试的广度和复杂度不同,选用针对该应用领域进行优化的计数仪更为合适。经优化的颗粒计数仪将内置各种药典测试标准,可自动计算并生成合格/不合格结果。此外,质量控制小组倾向于使用产品的品牌名称来描述待测样品,经优化的计数仪支持用户从下拉菜单中按名称选择产品,以便为每个样品选择所需的检测。

图 5. HIAC PharmSpec 软件的电子 SOP 功能支持用户根据待测产品的品牌名称来命名自动化 SOP 日常检测,用户可通过下拉框来选择此类日常检测。
结论
虽然业界关注的是 21CFR 第 11 部分电子记录的错误和遗漏,但潜在的问题是重新培训可能只是解决方案的一部分。手动 SOP不足以避免数据错误和遗漏的再次发生。自动化质量控制 SOP 的 QC 仪器既能够减少人为错误对数据完整性的影响,还可以通过减少技术人员执行SOP 所需的时间而节省成本。
参考文献
- Managing the Cost of Compliance in Pharmaceutical Operations, Frances Bruttin and Dr. Doug Dean, IBM Business Consulting Services, Pharmaceutical Sector, Aeschenplatz 2, CH-4002 Basel, Switzerland, April 2004
- An Analysis of FDA Warning Letters, Barbara Unger, Unger Consulting Inc., Pharmaceutical Online Guest Column, July 14, 2017
- Guidance for Industry: PAT — A Framework for Innovative Pharmaceutical Development, Manufacturing, and Quality Assurance, U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA) Division of Drug Information, HFD-240 Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane, Rockville, MD 20857 USA, September 2004
- Comparison of Manual versus Automated Trypan Blue Dye Exclusion Method for Cell Counting, Kristine S. Louis, Andre C. Siegel, Gary A. Levy, Industrial BioDevelopment Laboratory.
- Health How Stuff Works, How many skin cells do you shed every day?, by Ed Grabianowski. http://health.howstuffworks.com/skin-care/information/anatomy/shed-skin-cells.htm, published July 6, 2010
- Data Integrity and Compliance With CGMP, Guidance for Industry, April 2016, U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA) Division of Drug Information, HFD-240 Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane, Rockville, MD 20857 USA.
- USP<787> Subvisible Particulate Matter In Therapeutic Proteins, Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA) Division of Drug Information, HFD-240 Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane, Rockville, MD 20857 USA
- USP<788> Particulate Matter in Injections, Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA) Division of Drug Information, HFD-240 Center for Drug Evaluation
and Research Food and Drug Administration 5600 Fishers Lane, Rockville, MD 20857 USA - USP<1046> Cell and Gene Therapy Products – Analytical Methodologies, Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA) Division of Drug Information, HFD-240
Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane, Rockville, MD 20857 USA - Guidance for Industry, Part 11, Electronic Records; Electronic Signatures — Scope and Application August 2003 U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA)
Division of Drug Information, HFD-240 Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane, Rockville, MD 20857 USA - United States Pharmacopoeia U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research (CDER) Center for Biologics Evaluation and Research (CBER) Office of Regulatory affairs (ORA) Division of Drug Information, HFD-240 Center for Drug Evaluation and Research Food and Drug Administration 5600 Fishers Lane, Rockville, MD 20857 USA
- European Pharmacopeia (Ph. Eur.) Commission press release 18th March 2016 https://www.edqm.eu/sites/default/files/press_release_water_for_injections_march_2016_0.pdf EDQM Expert Workshop, 24 March 2011 European Directorate for the Quality of Medicines & Healthcare (EDQM) 7 allée Kastner, CS 30026 F -67081, Strasbourg



