上皮细胞
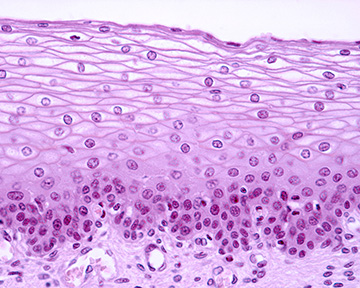
上皮细胞是一类多样化的紧密排列的细胞,沿皮肤、肺、胃肠道和泌尿生殖系统等主要器官的腔道排列成行,形成物理屏障,将它们彼此和外部环境分开。
形成和结构
上皮细胞可起源于胚胎的所有胚层的——外胚层、中胚层和内胚层。例如,角化细胞起源于外胚层,形成胃肠道内壁的细胞来自内胚层,而形成体腔内壁的细胞则来自中胚层。由于上皮细胞由快速分裂的干细胞发育而来,因此上皮也是一个主要的致癌部位。1
上皮组织形成初期,为附着在基底膜上的单层细胞,随着生长因子和细胞外基质在其与底层间充质的界面沉积而成熟。多蛋白复合物,包括跨膜整合素异质二聚体,使基底上皮细胞粘附于基底膜。胞间通讯是通过形成粘连、紧密的连接处以及通过桥粒来实现的,许多细胞基于此作为一个整体发挥作用。这些细胞间连接还有助于区分细胞的顶端、基底和侧表面,这对于确定上皮细胞的极性至关重要。2
上皮根据其厚度、特化功能和位置可分为几种类型,然而,它们具有一些共同的分子和细胞特征。根据它们的主要特性,可以进一步将其描述为保护性、分泌性或吸收性,但通常这三种功能是共存的。上皮根据其形状和层数进行分类:
- 细胞形状:鳞状、立方体、柱状
- 细胞层:单一(单层)或分层(多层)
- 特化上皮:纤毛上皮、移行上皮和腺上皮
功能
上皮的物理屏障赋予重要的保护和调节功能,包括分泌、选择性吸收、跨细胞运输和感觉感知。上皮细胞还招募或激活其他特化效应细胞,并有助于先天免疫。例如,它们依赖嗜酸性粒细胞来启动和增强免疫反应并发挥抗炎作用。证据还表明,上皮细胞和中性粒细胞分泌的某些多肽之间存在相似性,包括溶菌酶、乳铁蛋白和防御素。这可以归因于两种细胞类型共同表达指导这些抗菌物质生产的基因。3
大多数上皮细胞在整个生命过程中不断更新,不同上皮细胞更替的时间不同。例如,肠道上皮细胞每5天更新一次,而表皮需要4周才能恢复。多能干细胞为更新发动机。上皮干细胞来源于它们,在发育过程中被特化,并受上皮-间充质相互作用控制。2
上皮细胞-间充质转化(EMT)是上皮细胞失去极性和粘附性后,响应基因表达和翻译后调控变化而获得间充质表型的独特细胞过程。这种修饰赋予上皮细胞独特的侵袭性和迁移性,使其转化为间充质干细胞。众所周知,这一过程不仅对胚胎发生、伤口愈合等生理过程至关重要,对包括转移发生在内的病理过程也非常关键。揭示导致EMT激活的信号通路,可以为细胞表型可塑性和可能的治疗干预提供新见解。2
新兴研究
近期临床前和临床试验表明,在神经退行性疾病的治疗中,各种类型干细胞可用于支持丢失神经元的再生或恢复。未来,使用人羊膜上皮细胞可能是一种很有前途的细胞治疗方法,尤其是因为它具有较低的致肿瘤性或免疫原性风险,而且没有伦理问题。4
研究上皮细胞的工具
细胞标志物
细胞标志物可用于研究上皮细胞生物学,包括胚胎发育、癌变和EMT状态。传统上皮标志物为上皮膜抗原(EMA/MUC1)和泛细胞角蛋白,尽管并非所有上皮细胞都产生EMA。上皮标志物丢失也与某些癌的EMT和转移发展有关。5 上皮细胞可以通过以下表达来识别:
细胞粘附分子:上皮特异性抗原或上皮细胞粘附分子(EpCAM) 由大多数健康上皮细胞表达,但在粘膜鳞状上皮中看不到,如在上呼吸道和肠道中;E -钙粘蛋白在除神经元上皮细胞外的所有上皮细胞上表达。
细胞角蛋白:可以分为两个不同的亚型,包括酸性(A型,9-20)细胞角蛋白和碱性细胞角蛋白(B型,1-8),通常以异二聚体对形式存在,异二聚体对由两个亚型中每个亚型的一个蛋白组成。上皮细胞表达一种组织或器官特异性细胞角蛋白谱,可用于识别单个上皮细胞,例如,细胞角蛋白15是毛囊干细胞的标志物。5,6
CD66f或妊娠特异性β-1糖蛋白(PSBG-1)是由胎盘合胞滋养细胞、胎儿肝脏和髓系细胞系产生的。它在妊娠后期的母体血清中大量存在,据认为可以保护胎儿免受母体免疫系统的影响。7
| 表面标志物 | 别名 | 位置 |
|---|---|---|
| CD66e | CEACAM5, member of the CEA gene family | 表面,出生后仅在肿瘤细胞中发现 |
| CD66f | PSBG-1, member of the CEA gene family | 表面 |
| CD340 | HER2/erbB2, MLN 19 | 表面 |
| CD331 | FGFR1, BFGFR, FLT-2 | 表面 |
| CD324 | E-Cadherin, CDH1 | 表面 |
| CD326 | EpCAM, EGP314 | 表面 |
| CD318 | CDCP1, SIMA135, TRASK, gp140 | 表面 |
| CD249 | EAP, BP-1, glutamyl aminopeptidase | 表面 |
| CD118 | LIFR, Leukemia inhibitory factor receptor alpha | 表面 |
参考文献
1. Hinck, L., Näthke, I. (2014). Changes in cell and tissue organization in cancer of the breast and colon. Current opinion in cell biology, 26, 87–95. https://doi.org/10.1016/j.ceb.2013.11.003
2. Yang, J., Antin, P., et al. (2020) Guidelines and definitions for research on epithelial-mesenchymal transition. Nat Rev Mol Cell Biol. 2:41–352. DOI: https://doi.org/10.1038/s41580-020-0237-9
3. Ganz T. (2002). Epithelia: not just physical barriers. Proceedings of the National Academy of Sciences of the United States of America. 99(6). https://doi.org/10.1073/pnas.072073199
4. Huiming Xu, Jiaofei Zhang, et al. (2019). Therapeutic potential of Human Amniotic Epithelial cells on Injuries and Disorders in the Central Nervous System. Stem Cells International. DOI: https://doi.org/10.1155/2019/5432301
5. Guislaine Barriere, Pietro Fici, et al. (2014). Circulating tumor cells and epithelial, mesenchymal and stemness markers: characterization of cell subpopulations. ATM. 2:11. DOI: 10.3978/j.issn.2305-5839.2014.10.04
6. Zeisberg M, Neilson EG. (2009). Biomarkers for epithelial-mesenchymal transitions. J Clin Invest. 119(6):1429-37. doi: 10.1172/JCI36183.
7. Stockinger, H., Majdic, O., et al. (2003). Monoclonal Antibodies to Human Cell Surface Antigens. Current protocols in immunology, 53(1), A.4A.1–A.4A.49. https://doi.org/10.1002/0471142735.ima04as53

